hCCR-9兔单抗开发
目标:生成特异性识别7次跨膜蛋白hCCR-9的兔单克隆抗体
免疫原:hCCR9-mRNA-LNP复合物
筛选材料:hCCR9 过表达 CHO-K1 细胞系
挑战:没有可用的纯化蛋白且DNA免疫尝试失败
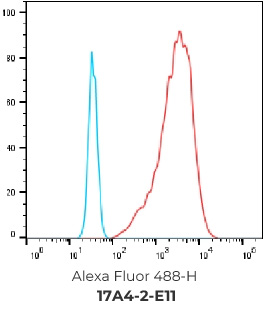
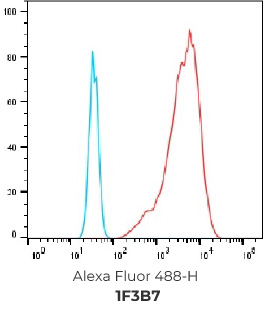
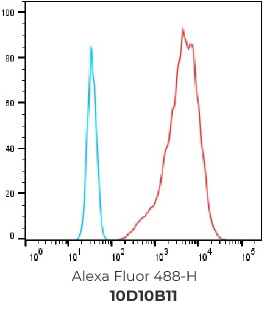
结果:成功筛选到394个FACS 阳性hCCR9克隆,且最终选择9个克隆进行交付
394个FACS 阳性克隆
选择排名前20的克隆进行NGS测序, 选择其中10个抗体进行重组表达和后续验证
客户选择其中9个抗体作为最终交付并进行重组表达
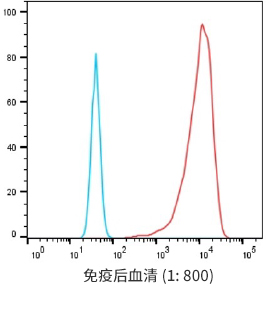
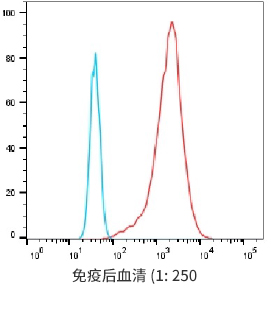
经过两轮hCCR9-LNP免疫后结果
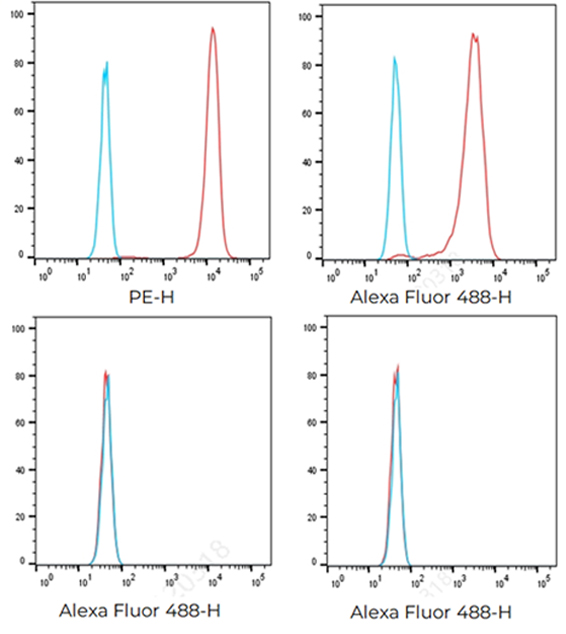
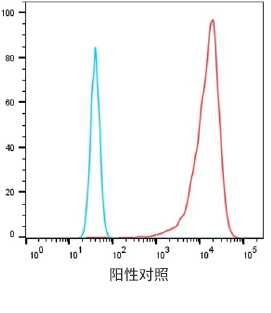
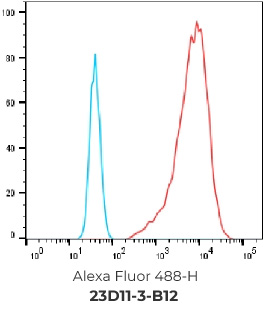
重组表达克隆的FACS结果
| 克隆 # | Median (+) MFI | Median (-) MFI | Median (+) MFI/ Median (-) MFI |
|---|---|---|---|
| 27F8-1 | 22098 | 35 | 631.4 |
| 39D4-1 | 22031 | 35 | 629.5 |
| 31D7-1 | 21240 | 35 | 606.9 |
| 37F5-1 | 21964 | 36 | 610.1 |
| 39B9-1 | 20046 | 36 | 556.8 |
| 39B9-2 | 21698 | 34 | 638.2 |
| 20G5-1 | 3776 | 36 | 104.9 |
| 39F3-1 | 4674 | 41 | 114.0 |
| 60G5-1 | 14559 | 38 | 383.1 |
| 49B12-1 | 10867 | 38 | 286.0 |
| Positive control | 11763 | 42 | 280.1 |
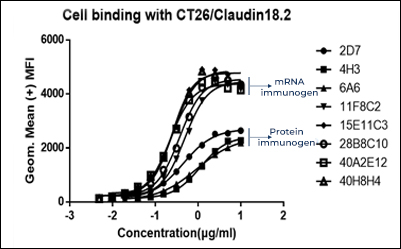
9个重组表达终克隆的EC50结果
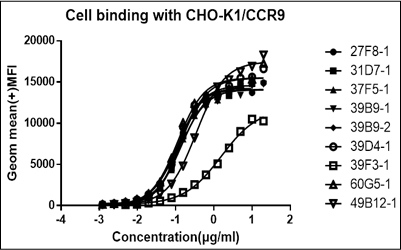
| 克隆 # | 27F8-1 | 31D7-1 | 37F5-1 | 39B9-1 | 39B9-2 | 39D4-1 | 39F3-1 | 60G5-1 | 49B12-1 |
|---|---|---|---|---|---|---|---|---|---|
| EC50 | 0.118 | 0.126 | 0.143 | 0.133 | 0.114 | 0.128 | 1.561 | 0.113 | 0.345 |
| R square | 0.997 | 0.996 | 0.996 | 0.995 | 0.998 | 0.992 | 0.996 | 0.990 | 0.997 |
hCCR-9鼠单抗开发
目标:开发针对7跨膜蛋白hCCR9的小鼠单克隆抗体
免疫原:hCCR9-mRNA-LNP复合物
筛选材料:hCCR9 过表达 CHO-K1 细胞系
挑战:没有可用的纯化蛋白且使用DNA免疫进行抗体开发失败
结果:成功筛选到9个hCCR9阳性克隆和7个经过验证的克隆 (客户选择)
1轮细胞融合
19 个FACS阳性母克隆
经过其他抗体验证和NGS测序筛选出9个FACS阳性克隆
7个进行后续交付
Isotype identification of 9 hybridoma clones
| 亚型 | IgG1, k | IgG2a, k | IgG2b, k | IgG3, k |
|---|---|---|---|---|
| 克隆号 | 58D7, 69D11, 80E9 | 69C5 | 50C11, 50G8, 53B4, 56B3 | 77F5 |
FACS EC50 of 7 recombinant antibody
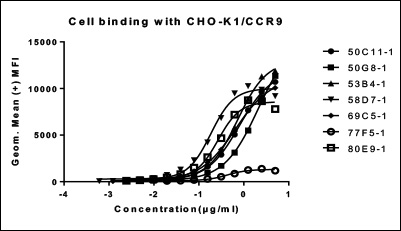
| 克隆号 | 50C11-1 | 50G8-1 | 53B4-1 | 58D7-1 | 69C5-1 | 77F5-1 | 80E9-1 |
|---|---|---|---|---|---|---|---|
| EC50 | 0.7974 | 2.121 | 0.7245 | 0.1847 | 0.6506 | 0.4246 | 0.266 |
| R2值 | 0.9997 | 0.9996 | 0.9987 | 0.9922 | 0.9997 | 0.9808 | 0.9899 |
7个最终挑选克隆的FACS结果
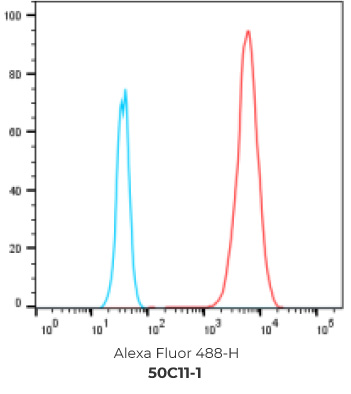
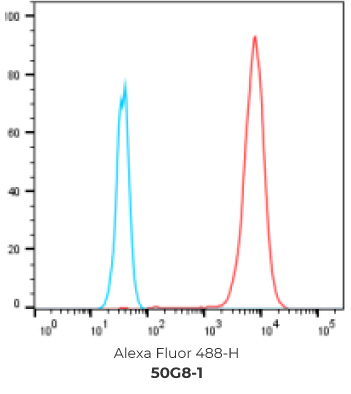
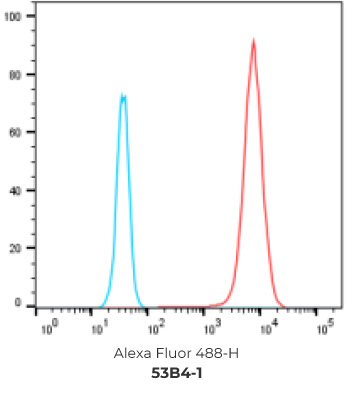
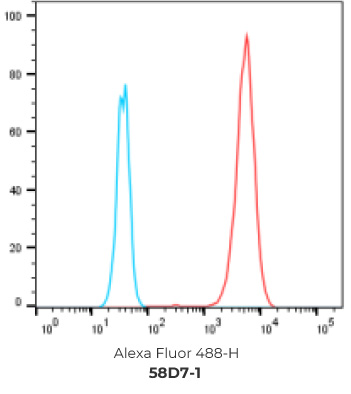
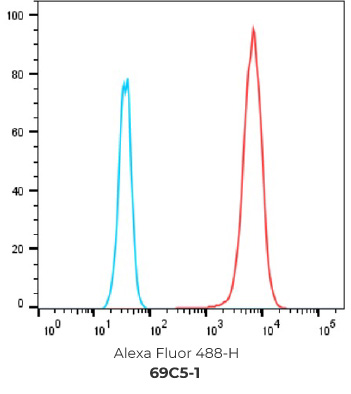
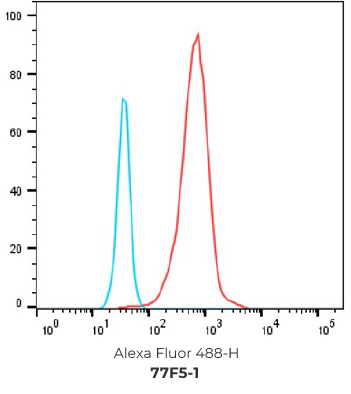
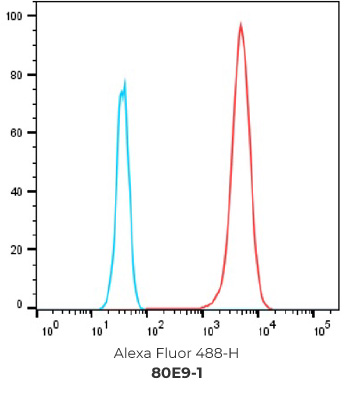
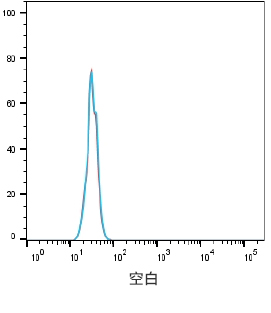
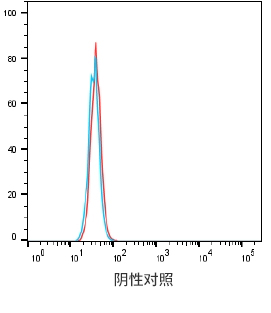
阴性对照细胞
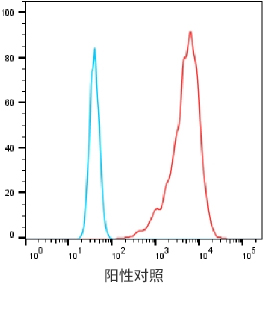
阳性过表达细胞