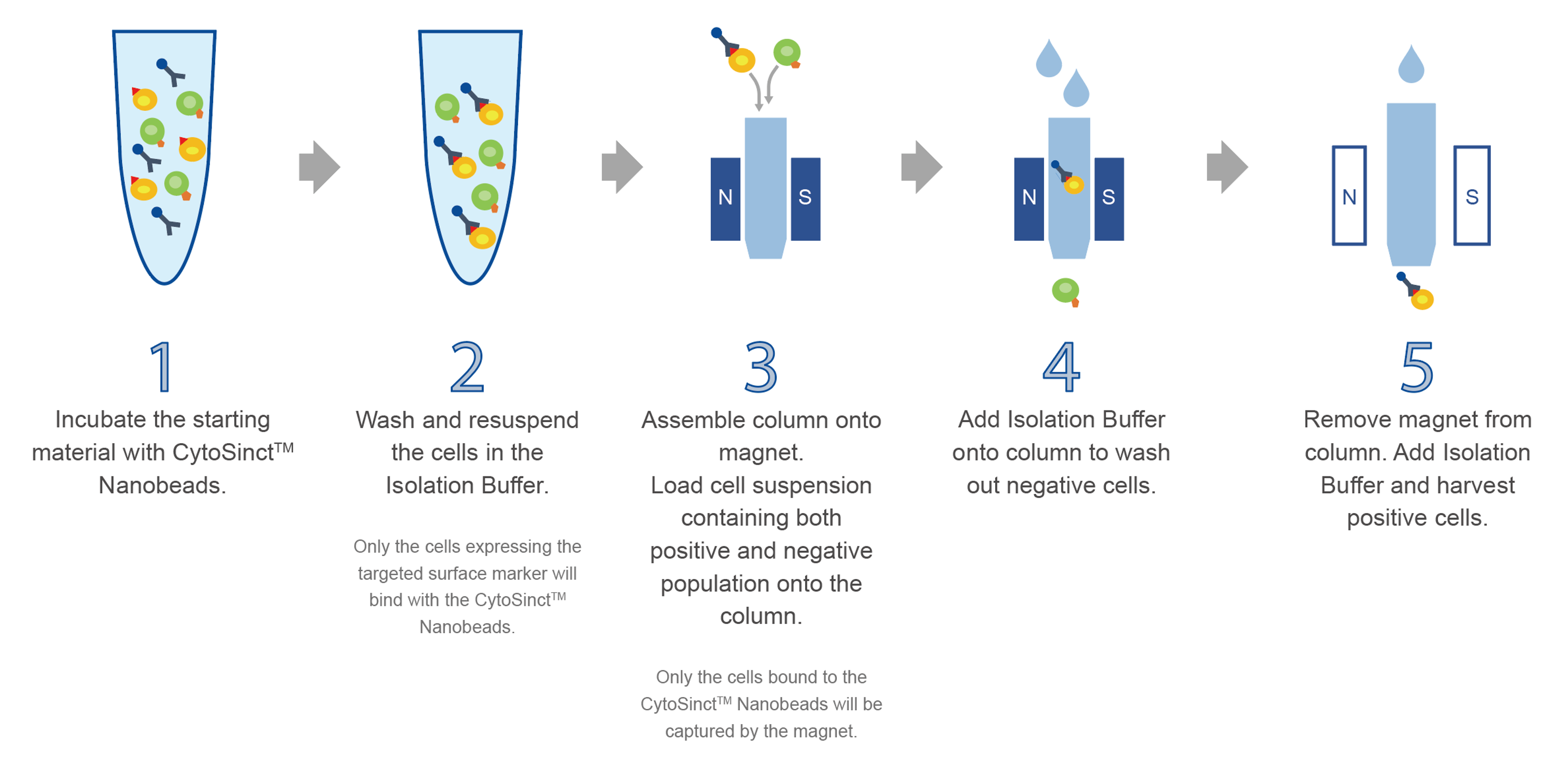
金斯瑞提供的CytoSinct™纳米分选磁珠是采用基于分选柱的分离方法,以实现目的细胞的分离。
*CytoSinct™纳米分选磁珠与金斯瑞提供的分选柱搭配使用,也可兼容其他供应商提供的分选柱。
{{ category.name }}
{{ item.name }}
暂无数据
金斯瑞提供的CytoSinct™纳米分选磁珠是采用基于分选柱的分离方法,以实现目的细胞的分离。
*CytoSinct™纳米分选磁珠与金斯瑞提供的分选柱搭配使用,也可兼容其他供应商提供的分选柱。

高纯度、高回收率、高活率的T细胞分选
CD4+ 和 CD8+ T 淋巴细胞联合富集是制备 CAR-T 细胞时常见的细胞分选策略。金斯瑞提供CytoSinct CD4 分选磁珠和 CytoSinct CD8 分选磁珠,两种磁珠同时孵育细胞进行分选,可以从单采血、外周血单个核细胞( PBMC)等样本中轻松获得高纯度、高回收率的目的细胞,同时能极大程度保留分选前的细胞活性。
Figure 1. 不同供者的单采血或 PBMC,使用 CytoSinct 或竞品 CD4、CD8 分选磁珠后进行流式检测,(A)分选后典型的流式散点图,(B)分选前后细胞活率,(C)分选后目的细胞纯度,(D)分选后 CD4、CD8 T 细胞回收率。
金斯瑞提供的CytoSinct™ TCR αβ Nanobeads 采用创新的一步法分选,简化了实验步骤,解决了传统方法过程繁琐、耗时长、损耗大等工艺问题,能够有效从 UCAR-T、γδ T 和 CAR-NK 样本中去除 αβT 细胞,并高效回收其余细胞组分。
不同品牌TCRαβ T细胞去除示意图
UCAR-T、 γδ T应用

Figure 2. 不同来源的 UCAR-T、γδ T 细胞,使用 CytoSinct TCR αβ 分选磁珠进行去除后流式检测 ,( A)分选后 CD3+细胞比例,( B)分选后CD3-细胞纯度及回收率。
CAR NK应用
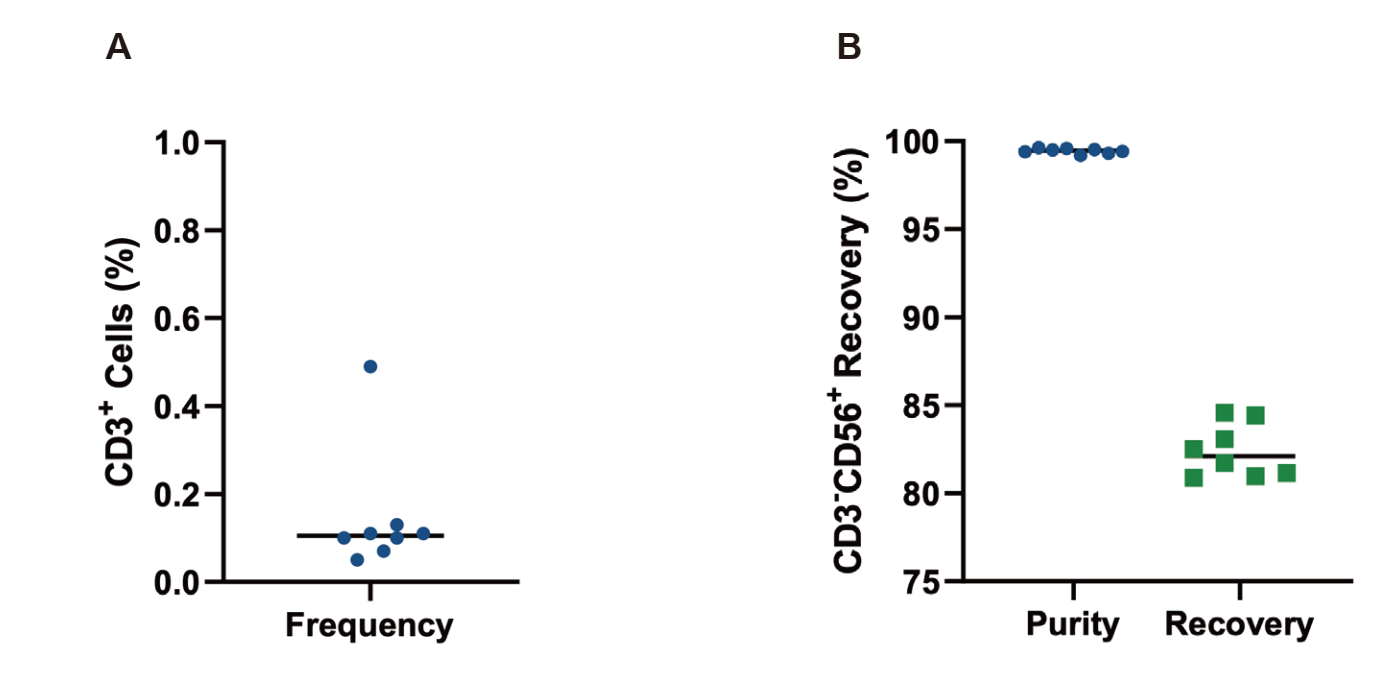
Figure 3. 不同来源的 CAR-NK 细胞,使用 CytoSinct TCR αβ 分选磁珠进行去除后流式检测 ,( A)分选后 CD3+ 细胞比例,( B)分选后CD3-CD56+NK 细胞纯度与回收率。
高效率富集 NK 细胞
细胞治疗中常用 CD3+ 细胞去除和 CD56+ 细胞富集从单采血、PBMC 等来源中富集 NK 细胞,进一步制备CAR-NK 细胞。金斯瑞提供 CytoSinct CD3 分选磁珠和 CytoSinct CD56 分选磁珠用于高效 NK 细胞分离。
Figure 4. 分别使用 CytoSinct CD3 和 CD56 分选磁珠对 PBMC 样本进行 CD3+ 细胞去除和 CD56+ 细胞富集,并用竞品 CD3、 CD56 磁珠作为对照。分别检测CD3 去除和 CD56 富集后细胞样本中 T细胞(A)、NKT细胞(B)以及 NK 细胞(C)阳性百分比,并计算整个过程 NK 细胞回收率(D)以及 CD56 富集中 NK 细胞回收率(E)。
安全性和特异性的两大升级
对抗体的Fc区域进行了人源化改造优化,其氨基酸序列为人源序列取代,降低异源性,极大程度减少了产生人抗鼠抗体(Human anti-mouse Antibodies,HAMA)的风险。
对抗体Fc区域进行了优化突变,降低其非特异结合Fc受体风险。为产品在安全性和特异性方面带来了两大升级。
Figure 5. 使用金斯瑞CytoSinct™ CD34分选磁珠对起始样本进行分选,经过流式CD34检测,结果表明金斯瑞CytoSinct™ CD34磁珠效果与竞品相当。
Figure 6. 使用 CytoSinct CD19 分选磁珠从 PBMC 样本中富集或去除CD19+ B细胞),流式检测结果(A)分选前CD19+细胞比例,(B)分选后CD19+ 细胞比例,(C)分选后CD19- 细胞比例。
